viernes, 16 de diciembre de 2016
Las 7 Reglas Para Alcanzar El Éxito De Steve Jobs Que No Conoces
CIENCIA TECNOLOGIA Y AMBIENTE
abrir aquí---> http://www.monografias.com/trabajos88/ecuaciones-y-reacciones-quimicas/ecuaciones-y-reacciones-quimicas.shtml
Ecuaciones Químicas:
Definición: Son expresiones matemáticas abreviadas que se utilizan para describir lo que sucede en una reacción química en sus estados inicial y final. En ella figuran dos miembros; en el primero, los símbolos o fórmulas de los reactantes, reaccionantes o reactivos y en el segundo los símbolos o fórmulas de los productos. Para separar ambos miembros se utiliza una flecha que generalmente se dirige hacia la derecha, indicando el sentido de la reacción:
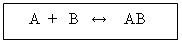
A + BC AB + C
Ej. : La ecuación química que describe la reacción entre el magnesio y el oxígeno es:
2 Mg + O2 2 MgO Reactantes Producto
Significado de las ecuaciones químicas:
a) Cualitativo: Indica la clase o calidad de las sustancias reaccionantes y productos. En la ecuación anterior, el magnesio reacciona con el oxígeno para obtener óxido de magnesio
b) Cuantitativo: Representa la cantidad de átomos, moléculas, el peso o el volumen de los reactivos y de los productos.
En la ecuación química anterior, se entiende que dos moléculas (o moles) de magnesio, reaccionan con una molécula ( o mole) de oxígeno para obtenerse dos moléculas ( o moles) de óxido de magnesio. También se puede calcular la cantidad en gramos del producto, tomando como base los pesos atómicos de los reaccionantes (Con ayuda de la Tabla Periódica) .
Características de las Ecuaciones Químicas:
Los reactantes y productos se representan utilizando símbolos para los elementos y fórmulas para los compuestos.
Se debe indicar el estado físico de los reactantes y productos entre paréntesis: (g), (l), (s), (ac.) si se presentan en estado gaseoso, líquido, sólido o en solución acuosa respectivamente.
El número y tipo de átomos en ambos miembros deben ser iguales, conforme al principio de conservación de la masa; si esto es así, la ecuación está balanceada.
II.- Reacciones Químicas:
Definición: Son procesos químicos donde las sustancias intervinientes, sufren cambios en su estructura, para dar origen a otras sustancias. El cambio es más fácil entre sustancias líquidas o gaseosas, o en solución, debido a que se hallan más separadas y permiten un contacto más íntimo entre los cuerpos reaccionantes.
También se puede decir que es un fenómeno químico, en donde se producen sustancias distintas a las que les dan origen.
Características o Evidencias de una Reacción Química:
Formación de precipitados.
Reglas:
Ej. :
En toda reacción se conservan los átomos y las cargas (si hay iones)
No puede ocurrir un proceso de oxidación o de reducción aislado, ambos ocurren simultáneamente.
No se pueden formar productos que reaccionen enérgicamente con alguno de los productos obtenidos.
Na3N + 3H2O 3 NaOH + NH3
Tipos de Reacciones Químicas:
A) De acuerdo a las sustancias reaccionantes:
masa molecular:

Ej. :
Reacciones de composición, adición o síntesis:
Cuando dos o más sustancias se unen para formar una más compleja o de mayor
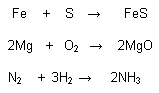
Reacciones de descomposición:
Cuando una sustancia compleja por acción de diferentes factores, se descompone en otras más sencillas:
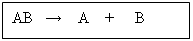
Ej. :
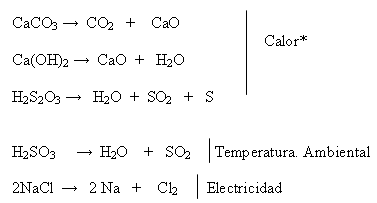
Cuando las descompone el calor, se llaman también de disociación térmica.
Reacciones de simple sustitución:
Denominadas también de simple desplazamiento cuando una sustancia simple reacciona con otra compuesta, reemplazando a uno de sus componentes.
Ej. :
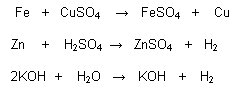
Reacciones de doble sustitución:
También se denominan de doble desplazamiento o metátesis y ocurren cuando hay
intercambio de elementos entre dos compuestos diferentes y de esta manera originan nuevas sustancias. * Se presentan cuando las sustancias reaccionantes están en estado iónico por encontrarse en solución, combinándose entre sí sus iones con mucha facilidad, para formar sustancias que permanecen estables en el medio reaccionante:
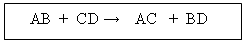
Ej. :
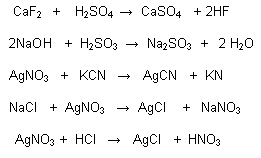
Reacciones Reversibles:
Cuando los productos de una reacción pueden volver a reaccionar entre sí, para generar los reactivos iniciales. También se puede decir que se realiza en ambos sentidos.
Ej. :
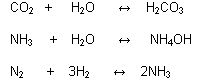
Reacciones Irreversibles:
Cuando los productos permanecen estables y no dan lugar a que se formen los reactivos iniciales.
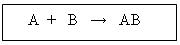
Ej. :
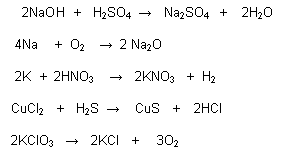
Toda reacción es más o menos reversible; pero en muchos casos esta reversibilidad es tan insignificante que se prefiere considerar prácticamente irreversible.
B) De acuerdo a su energía:
En toda reacción química hay emisión o absorción de energía que se manifiesta como luz y/o calor. Aquí aparece el concepto de Entalpía, entendida como la energía que se libera o absorbe.
Reacciones Exotérmicas:
Cuando al producirse, hay desprendimiento o se libera calor.
Ej. :
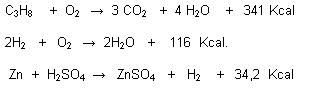
Reacciones Endotérmicas:
Cuando es necesario la absorción de calor para que se puedan llevar a cabo.
Ej. :
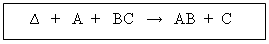
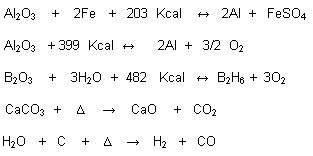
La energía liberada o absorbida se denomina calor de reacción o entalpía (H) por consiguiente:
En una reacción exotérmica la entalpía es negativa
En una reacción endotérmica la entalpía es positiva
C) Reacciones Especiales:
Reacción de Haber:
Permite obtener el amoniaco partiendo del hidrógeno y nitrógeno
sustancias:
N2 + 3H2 ? 2NH3
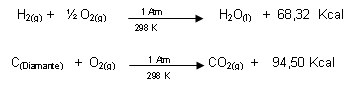
Reacción Termoquímica:
En estas reacciones se indica la presión, temperatura y estado físico de las
Reacción de Combustión:
En estas reacciones, el oxígeno se combina con una sustancia combustible y como consecuencia se desprende calor y/o luz. Las sustancias orgánicas pueden presentar reacciones de combustión completa o incompleta:
- R. Completa: Cuando se forma como producto final CO2 y H2O (en caso de sustancias orgánicas)
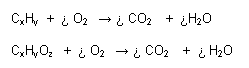
Ej. :
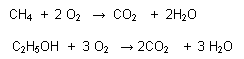
R. Incompleta: Cuando el oxígeno no es suficiente, se produce CO y H2O, aunque muchas veces se produce carbón.
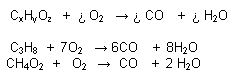
Reacción Catalítica:
Se acelera por la intervención de sustancias llamadas catalizadores que permanecen inalterables al final de la reacción.
Catalizador: Sustancia que acelera la reacción. No reacciona. Se recupera todo
Ej. :
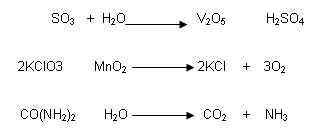
Reacción REDOX:
Reacciones en donde hay variación de los estados de oxidación de las sustancias por transferencia de electrones.
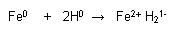
Reacción de Neutralización:
Consiste en la reacción de un ácido con una base.
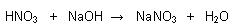
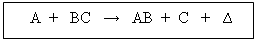
III.- Mecanismo de Reacción:
Definición: Son las etapas en que ocurre una reacción química. La mayoría de las reacciones ocurren en varias etapas consecutivas, cada una de las cuales se denomina reacción elemental; el conjunto total de estas reacciones elementales, por las que transcurre una reacción global, se denomina mecanismo de reacción.
Según Fco. A. Villegas (Univ. de Colombia), para que se produzca una reacción química tal como:

Se requiere una serie de etapas intermedias o etapas sucesivas y simultáneas . Un posible mecanismo para la reacción mencionada es el siguiente:

En la primera etapa la molécula de A2 se descompone en dos átomos iguales de manera rápida.
En la segunda etapa, la más lenta de todo el proceso, la molécula de B2 se divide también en dos átomos .
En las etapas tercera y cuarta y que ocurren de manera simultánea, un átomo de A, se combina con un átomo de B, para formar el compuesto AB de manera más rápida que la etapa segunda.
La suma algebraica de todas las etapas, resulta la reacción neta.
Como se aprecia, cuando una reacción ocurre en varias etapas, generalmente una de ellas, es más lenta que las demás, actuando como reguladora de la velocidad de reacción global,, tomando por ello el nombre de etapa determinante o controlante de la velocidad de reacción.
Ej. :

La reacción entre el cloruro de yodo y el hidrógeno, para formar yodo y cloruro de hidrógeno, si se realizara en una sola etapa, sería de tercer orden ( de segundo orden respecto al ICl y de primero respecto al H2), pero se ha encontrado experimentalmente que la reacción es de primer orden para ambos reactivos, y por tanto, de segundo orden global. Esto se puede entender suponiendo que la reacción ocurre en dos partes o etapas, como las siguientes:

La primera reacción es lenta, comportándose como la controlante de la velocidad, la que explica los resultados experimentales. Como es lógico, cuando una reacción ocurre en varias etapas, la suma de estas reacciones parciales es igual a la reacción final.
IV.- Reacciones en Cadena:
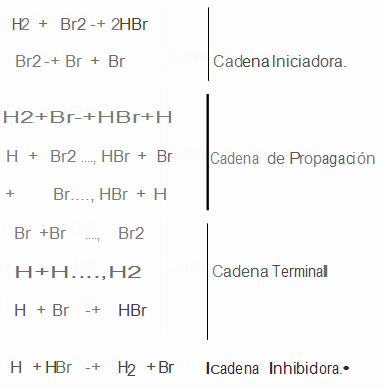
Existen diversas reaccione químicas que ocurren en varias etapas, en las que además de formarse los productos, se regeneran los reactantes que dieron inicio a la reacción, formándose una especie de "cadena" en la que se repiten los eslabones, por lo que reciben el nombre de Reacciones en cadena.
En estas reacciones es frecuente la intervención de radicales libres, esto es, moléculas o átomos que tienen normalmente una valencia sin saturar.
Ej. : En la descomposición térmica del acetaldehído ocurre lo siguiente:
a) CH3CHO CHO + CH3 (iniciación)
b) H3CHO + CH3 CH4 + CO + CH3 (propagación)
c) 2CH3 CH3 CH3 (terminación)
El primer proceso, es una descomposición del acetaldehído en radicales formaldehído y metilo, produciéndose la reacción de iniciación de la cadena , (donde una molécula absorbe energía en forma de calor, luz o radiación ultravioleta) dando inicio al proceso total y produciéndose además radicales metilo, que son los portadores de la cadena y que tras el segundo proceso, llamado de propagación de la cadena, ( se lleva a cabo mediante el proceso de los radicales libres, uniendo dos elementos y dejando uno libre)puede causar la descomposición de muchas moléculas de acetaldehído. Si no fuera por la reacción tercera, llamada de terminación de la cadena,(los átomos se unen y forman moléculas) en donde se combinan entre sí los dos radicales metilo, la reacción no concluiría hasta terminar todo el acetaldehído, porque un solo radical metilo lo podría descomponer todo, puesto que al hacerlo según el segundo proceso, se regeneraría metilo. También se puede considerar la cadena inhibidora cuando un átomo choca con determinada molécula inhibiendo toda la reacción. Veamos otro ejemplo:
En la ecuación:
MATEMATICA
Variables dependientes. Una variable dependiente es aquella cuyos valores dependen de los que tomen otra variable. La variable dependiente en una función que suele representar por y. La variable dependiente se representa en el eje ordenadas.

Una variable independiente es aquella cuyo valor no depende de otra variable. Es aquella característica o propiedad que se supone es la causa del fenómeno estudiado. En investigación experimental se llama así a la variable que el investigador manipula.


FIGURAS POLIGONALES:
En geometría, un polígono es una figura plana compuesta por una secuencia limitada de segmentos rectos consecutivos que cierran una región en el plano. Estos segmentos son llamados lados, y los puntos en que se intersectan se llaman vértices.El interior del polígono es llamado área. El polígono es el caso bidimensional del politopo, figura geométrica general definida para cualquier número de dimensiones. A su vez, un politopo de tres dimensiones se denomina poliedro, y de cuatro dimensiones se denomina polícoro.

Una variable independiente es aquella cuyo valor no depende de otra variable. Es aquella característica o propiedad que se supone es la causa del fenómeno estudiado. En investigación experimental se llama así a la variable que el investigador manipula.


FIGURAS POLIGONALES:
En geometría, un polígono es una figura plana compuesta por una secuencia limitada de segmentos rectos consecutivos que cierran una región en el plano. Estos segmentos son llamados lados, y los puntos en que se intersectan se llaman vértices.El interior del polígono es llamado área. El polígono es el caso bidimensional del politopo, figura geométrica general definida para cualquier número de dimensiones. A su vez, un politopo de tres dimensiones se denomina poliedro, y de cuatro dimensiones se denomina polícoro.

Etimología
La palabra polígono deriva del griego antiguo πολύγωνος (polúgonos), a su vez formado por πολύ (polú) ‘muchos’ y γωνία (gōnía) ‘ángulo’,3 4 5 aunque hoy en día los polígonos son usualmente entendidos por el número de sus lados.
La noción geométrica elemental ha sido adaptada de distintas maneras para servir a propósitos específicos. A los matemáticos a menudo les interesan sólo las líneas poligonales cerradas y los polígonos simples (aquellos en los cuales sus lados sólo se intersecan en los vértices), y pueden definir un polígono de acuerdo a ello. Es requisito geométrico que dos lados que se intersecan en un vértice formen un ángulo no llano (distinto a 180°), ya que de otra manera los segmentos se considerarían partes de un lado único; sin embargo, esos vértices podrían permitirse algunas veces. En el ámbito de la computación, la definición de polígono ha sido ligeramente alterada debido a la manera en que las figuras son almacenadas y manipuladas en la computación gráfica para la generación de imágenes.
Línea poligonal
Se denomina línea poligonal al conjunto de segmentos unidos sucesivamente por sus extremos (el extremo de cada segmento es origen del siguiente), tal que dos segmentos sucesivos no están alineados (en tal caso se considera como un único segmento).6
Las líneas poligonales pueden ser abiertas o cerradas, un polígono está conformado por una línea poligonal cerrada.7
Elementos de un polígono
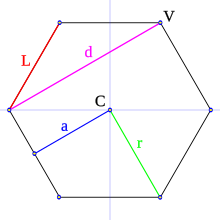
En un polígono se pueden distinguir los siguientes elementos geométricos:
- Lado (L): es cada uno de los segmentos que conforman el polígono.
- Vértice (V): es el punto de intersección (punto de unión) de dos lados consecutivos.
- Diagonal (D): es el segmento que une dos vértices no consecutivos.
- Perímetro (P): es la suma de las longitudes de todos los lados del polígono.
- Semiperímetro (SP): es la mitad del perímetro.
- Ángulo interior (AI): es el ángulo formado, internamente al polígono, por dos lados consecutivos.
- Ángulo exterior (AE): es el ángulo formado, externamente al polígono, por un lado y la prolongación de un lado consecutivo.
- Interior de un polígono es el conjunto de todos los puntos que están en el interior de la región que delimita dicho polígono. El interior es un abierto del plano.
- Exterior de un polígono es el conjunto de los puntos que no están en la poligonal (frontera) ni en el interior. El exterior es un abierto del plano.8
- Si el complemento (exterior) de una región poligonal es inconexo, este constará de varios fragmentos conexos llamados componentes. Uno y solo uno de los componente es ilimitado; todos los demás son limitados, a estos últimos se llaman huecos. Cada hueco con su frontera es un polígono.9
En un polígono regular se puede distinguir, además:
- Centro (C): es el punto equidistante de todos los vértices y lados.
- Ángulo central (AC): es el ángulo formado por dos segmentos de recta que parten del centro a los extremos de un lado.
- Apotema (a): es el segmento que une el centro del polígono con el centro de un lado; es perpendicular a dicho lado.
- Diagonales totales
, en un polígono de
lados.
- Intersecciones de diagonales
, en un polígono de
vértices.
- Todo polígono regular de n lados, puede ser descompuesto en un conjunto ordenado de n-2 triángulos, con un vértice común y la suma de las áreas de los triángulos sea igual al área del polígono.
Clasificación
Existen varias clasificaciones posibles de los polígonos. Para ver una clasificación basada en su número de lados, vea la tabla inferior.
Clasificación de los polígonos según su contorno
| Clasificación de los polígonos según la forma de su contorno. | ||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Según las propiedades que cumpla el contorno del polígono, es posible realizar las siguientes clasificaciones.
- Simple, si ningún par de aristas no consecutivas se corta. Equivalentemente, su frontera tiene un solo contorno.9
- Complejo o Cruzado, si dos de sus aristas no consecutivas se intersecan.10
- Convexo, si todo segmento que une dos puntos cualesquiera del contorno del polígono yace en el interior de este. Todo polígono simple y con todos sus ángulos internos menores que 180º es convexo.
- No convexo, si existe un segmento entre dos puntos de la frontera del polígono que sale al exterior del mismo. O si existe una recta capaz de cortar el polígono en más de dos puntos.
- Cóncavo, si es un polígono simple y no convexo.
- Equilátero, si tiene todos sus lados de la misma longitud.
- Equiángulo, si tiene todos sus ángulos interiores iguales.
- Regular, si es equilátero y equiángulo a la vez.
- Irregular, si no es regular. Es decir, si no es equilátero o equiángulo.
- Cíclico, si existe una circunferencia que pasa por todos los vértices del polígono. Todos los polígonos regulares son cíclicos.
- Ortogonal o Isotético, si todos sus lados son paralelos a los ejes cartesianos
o
.11
- Alabeado, si sus lados no están en el mismo plano.
- Estrellado, si se construye a partir de trazar diagonales en polígonos regulares. Se obtienen diferentes construcciones dependiendo de la unión de los vértices: de dos en dos, de tres en tres, etc.
- Reticular es simple y, al representarlo en un reticulado, cada vértice yace exactamente en un vértice de cuadrado unitario del reticulado (en este caso funciona la fórmula de Pick).
INGLES
El uso de Can y Can't, oraciones y preguntas con este verbo:
El verbo defectivo “Can” corresponde al español a "Poder", este verbo es ampliamente utilizado en inglés para expresar lo siguiente:
1.- Posibilidad de ciertos sucesos.
2.- La habilidad o capacidad de personas / cosas.
3.- Para pedir / dar permiso.
4.- Para pedir / ofrecer cosas.
Como se puede ver, es un verbo muy flexible que podemos utilizar en una enorme cantidad de situaciones. Se van a explicar estas 4 funciones de “Can” que hemos visto pero antes veamos como estructurar oraciones afirmativas y negativas, además de preguntas para complementar el tema.
Oraciones afirmativas con "Can"
Como puede verse en los ejemplos la estructura básica consiste en:
Pronoun / name + can + action verb + Complement
Nótese que estas oraciones a pesar de que están formuladas como presente simple, no se cambia el verbo en la tercera persona del singular (He, She, It). En los siguientes ejemplos se puede ver esta explicación:
He can work today.
He can works today.
She can wash the dishes.
She can washes the dishes.
It can play videos.
It can plays videos.
Oraciones negativas con "Can't"
Básicamente:
Pronoun / name + can't + action verb + Complement
Este tipo de oraciones de naturaleza negativa conserva las propiedades del verbo de acción que las oraciones afirmativas, es decir, el verbo no cambia en función de la persona de quien se hable.
Nota: Es muy común en el inglés (al hablar y escribir) usar la contracción "Can't" en lugar de "Cannot".
Oraciones Interrogativas con "Can"
Para preguntas de "Can":
Can + Pronoun / name + action verb + Complement?
Ahora que hemos visto la forma correcta de estructurar estas oraciones, volvamos al principio para explicar en qué consisten cada una de las 4 formas en que podemos usar "Can" y "Can't".
1- Posibilidad de ciertos sucesos
a) I can go to the market in the afternoon.
(Puedo ir al mercado en la tarde.)
b) We can visit Christian next week
(Nosotros podemos visitar a Cristian la próxima semana.)
c) It can be rainy tomorrow.
(Puede estar lluvioso mañana.)
d) She can't come to the party tonight.
(Ella no puede venir a la fiesta esta noche.)
e) Can you arrive early today?
(¿Puedes llegar temprano hoy?)
2.- La habilidad o capacidad de personas / cosas
a) Laura can swim very well.
(Laura puede nadar muy bien.)
b) They can play the piano.
(Ellos pueden tocar el piano.)
c) It can run desktop software and modern apps.
(Puede correr programas de escritorio y aplicaciones modernas.)
d) He can't cook. He always burns the food.
(Él no puede cocinar. El siempre quema la comida.)
e) Can she drive a standard car?
(¿Puede ella conducir un auto estándar?)
3.- Para pedir / dar permiso
3.1.- Para pedir permiso
a) Can she come with me?
(¿Puede ella venir conmigo?)
b) Can I come in?
(¿Puedo entrar?)
3.2.- Para dar permiso
a) You can stay.
(Te puedes quedar.)
b) They can visit their grandparents tomorrow.
(Ellos pueden visitar a sus abuelos mañana.
4.- Para pedir / ofrecer cosas
4.1- Para pedir cosas
a) Can you help me, please?
(¿Puedes ayudarme, por favor?)
b) Can you work in our team?
(¿Puedes trabajar en nuestro equipo?)
4.2- Para ofrecer cosas
a) Can I help you?
(¿Puedo ayudarte?)
b) Can I take your order?
(¿Puedo tomar su orden?)
Hasta el momento solo se han visto el tipo de preguntas que se responden con "Si" o "No". Aquellas que comienzan con el verbo auxiliar "Can"
Ejemplos:
- Can you dance?
- No, I can't.
- Can you work with Excel?
- Yes, I can.
- Can he swim?
- Yes, he can.
- Can she cook a pizza?
- No, she can't.
- Can we understand the lesson?
- Yes, we can.
- Can they speak french?
- No, they can't.
No obstante, tambien se pueden realizar preguntas específicas utilizando las palabras "Wh-" en este mismo curso.
Véase el siguiente ejemplo de conversación:
- Where can I go in Texas? (¿A dónde puedo ir en Texas?)
- You can go to the Plaza Mall. (Puedes ir a la Plaza Mall.)
- What can I do there? (¿Qué puedo hacer ahí?)
- You can hang out with your friends. (Puedes pasar el rato con tus amigos.)
- What else can I do there? (¿Qué más puedo hacer ahí?)
- You can meet interesting people. (Puedes conocer gente interesante.)
- When can I go there? (¿Cuándo puedo ir ahí?)
- You can go there every day. (Puedes ir ahí todos los días.)
- What things can I buy there? (¿Qué cosas puedo comprar ahí?)
- You can buy jewelry and clothes. (Puedes comprar joyería y ropa)
Mirar Aquí----> http://www.ingenierogeek.com/2013/12/curso-ingles-medio-gratis-uso-de-can-cannot-verbo-defectivo.html
Mirar Aquí----> http://www.ingenierogeek.com/2013/12/curso-ingles-medio-gratis-uso-de-can-cannot-verbo-defectivo.html
Suscribirse a:
Comentarios (Atom)




